在2004年那次首创性的实验之后的几年里,Deisseroth的团队和其他人找到了前两个问题的答案:是的,没问题。近日,他们用另一个肯定的答案回答了第三个问题,成功地推出了一种无植入物的技能 -- 首次证明了光遗传学结合光和基因工程来掌握脑细胞,无需手术就能精确地打开和关闭细胞。
“这是16年来研究的一个很好的总结,”斯坦福大学的神经科学家和生物工程师Deisseroth说,“我们花了很多年的韶光才弄清楚如何让它事情。”该研究的详细成果揭橥在近日的Nature Biotechnology杂志上。

光遗传学包括对动物大脑进行基因工程,在神经元膜中表达一种叫做视蛋白的光敏蛋白。视蛋白对光脉冲的反应既可以勾引神经元“点火”,也可以抑制神经元的引发能力。光遗传学已经被用于绘制大脑路径图,识别繁芜行为是如何被调节的,在老鼠身上产生缺点影象等等。在其他技能中,它也被用于开拓光基因起搏器。
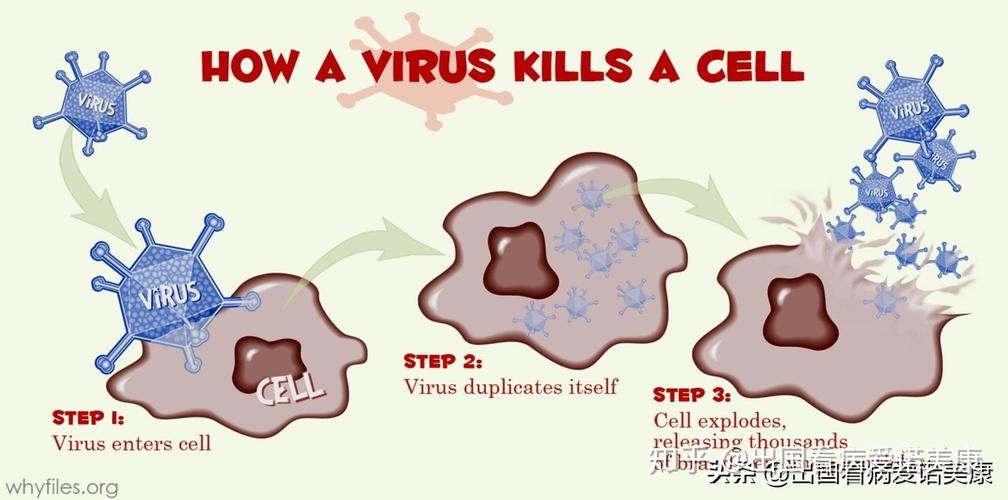
大多数时候,得到大脑内部的光脉冲来掌握细胞须要有侵入性的植入物:从栓系的光纤到胡椒粒大小的无线植入物,再到可伸缩的脊柱植入物。
今年4月,Guoping Feng和麻省理工学院的同事与Deisseroth一起演示了一种微创的光遗传学系统,该系统须要在头骨上钻一个小孔,然后利用蓝光掌握6毫米深的表达视蛋白的神经元。这种方法利用了一种视蛋白,它以一种循规蹈矩的办法缓慢激活神经元。
在最近的一项研究中,Deisseroth和他的同事们试图在不进行手术的情形下实现深度和快速的光遗传学。斯坦福大学的研究小组在老鼠的脑细胞中表达了一种叫做ChRmine(发音像深赤色的“胭脂红”)的强效视蛋白,该蛋白是去年Deisseroth的研究小组在一种海洋生物中创造的。然后,他们在颅骨表面发出红光,激活中脑和脑干的神经回路,深度可达7毫米。科学家们关掉了毫秒级的精密电路。Deisseroth表示:“这真的很好,比我们预期的要好得多。”
该小组随后测试了该系统的有效性。在一个例子中,他们用光快速而精确地阻挡了小鼠的癫痫产生发火,而在另一个例子中,他们通过激活产生血清素的神经元来促进小鼠的社交行为。
大多数光遗传学技能都是用针头将带有视蛋白基因的病毒直接注射到大脑中。为了避免这种情形,斯坦福大学的研究小组利用了加州理工学院开拓的一种可以注射到血液中的PHP病毒。然后病毒穿过血脑樊篱,将其有效载荷视蛋白基因通报给脑细胞。在这种情形下,纵然是基因的通报也是无创的,没有针头穿透大脑。
Deisseroth的团队现在正在鱼身上测试这种非侵入性技能,并与其他人互助将其运用于非灵长类动物。他们还与西雅图的Allen研究所互助,开拓细胞中含有氯胺的老鼠品系。“我们希望这些将是一个广泛可用和适用的研究工具,”Deisseroth说,“我们很高兴能与大家分享这种能力。”